广东中山市_广东中山第一中学2017届高三上学期第一次统测化学试题答案
来源:模拟试题 发布时间:2020-01-17 点击:
【www.greenkl.com--模拟试题】
本站为广大考生免费带来各种考前考后复习资料,帮助大家备战高考,广东中山第一中学2017届高三上学期第一次统测化学试题答案。中山一中2017届高三第一次统测 化学试题
本卷可能用到的相对原子质量:Fe-56 Al-27 O-16 Cu-64 Na-23 C-12 H-1
1. 下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeC12溶液中 ②过量NaOH溶液和明矾溶液馄合
③少量Ca (OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2
A.①②③④⑤ B.只有①④ C.只有②③ D.只有③④⑤
2. 下列有关金属的说法中,正确的是
①纯铁不容易生锈 ②钠着火用水扑灭 ③KSCN溶液可以检验Fe3+
④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金
A.①③④ B.②③④⑤ C.①③④⑤ D.①②⑤
3. 下列反应中,改变反应物的用量或浓度,不会改变生成物的是
A.铜和硝酸反应 B.二氧化碳通入氢氧化钠溶液中
C.细铁丝在氯气中燃烧 D.氯化铝与氢氧化钠溶液反应
4. 向一种溶液中滴加另一种溶液后,溶液的颜色不发生显著变化的是
A.氯化亚铁溶液中加入双氧水 B.硫酸亚铁酸性溶液中滴加硝酸钾溶液
C.硫酸铜溶液中滴加硝酸钡溶液 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
5. 以下物质可以通过化合反应直接制得的是
A.Al(OH)3 B. Fe(OH)3 C.Fe(OH)2 D.H2SiO3
6. 将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100 mL,则NaOH 溶液的浓度为
A.0.1 mol.L-1 B.0.2 mol.L-1 C.0.4 mol.L-1 D.0.8 mol.L-1
7. 在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、、Na+、Cl-、HCO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.水电离出的c(H+)=10一13mol·L一1的溶液中:K+、、Na+、、SO42-、、AlO2-
D.有较多Fe3+的溶液中:Na+、NH4+、SCN一、HCO3-
8. 为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是:
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
③Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
④Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑤Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
A.①③⑥ B. ②③⑤ C.①②⑤ D.①④⑤
9. 下列解释事实的方程式不正确的是
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-== BaSO4↓+2H2O
B.铁盐净水的原理:Fe3++3H2OFe(OH)3(胶体)+3H+
C.用少量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2
D.Fe2O3溶于过量氢碘酸溶液中:Fe2O3 + 6H+ + 2I- = 2Fe2++ I2 + 3H2O
10. 下列化学反应的离子方程式正确的是
A.小苏打溶液中加入过量的澄清石灰水:Ca2++2OH-+2HCO3-= CaCO3↓+ CO32-+2H2O
B.纯碱溶液中滴加少量盐酸:CO32-+H+= HCO3-
C. 硫化亚铁溶于稀硝酸中:FeS+2H=Fe2++H2S↑
D. NH4HCO3溶于过量的NaOH溶液中:HCO3+OH-=CO32-+H2O
11. NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.2.5mL 16mol·L-1浓硫酸与足量铜反应,转移电子数为0.04NA
C.7.8g Na2S和Na2O2的固体混合物中含有的阴离子数等于0.1NA
D.常温下,5.6 g 铁钉与足量浓硝酸反应,转移的电子数为0.3 NA
12. 已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。下列结论正确的是
A.①②③均是氧化还原反应
B.反应②中氧化剂与还原剂的物质的量之比为1∶6
C.氧化性强弱顺序是:K2Cr2O7>I2>Fe2(SO4)3
D.反应③中0.1mol还原剂共失去电子数为0.5NA
13. 下列叙述中正确的是( )
A.将高温水蒸气通过炽热的铁粉,铁粉变红色
B.向Fe(OH)3胶体中滴加稀H2SO4,先出现沉淀,后沉淀溶解
C.向FeCl2溶液中加入几滴KSCN溶液,溶液变为血红色,则FeCl2溶液完全变质
D.铝在空气中耐腐蚀,所以铝是不活泼金属
14. 下列物质的转化在给定条件下能实现的是

A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
15. 氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可生成CuH。下列叙述中错误的是( )
A.“某物质”具有还原性
B. CuH与盐酸反应可能产生H2
C.CuH与足量稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl
高中化学模拟题
16. 下列A—D四组,每组有两个反应,其中两个反应能用同一离子方程式表示的是:
(Ⅰ) (Ⅱ) A 少量H2SO4滴入Ba(OH)2溶液中 少量NaHSO4滴入Ba(OH)2溶液中 B 少量NaOH滴入Al2(SO4)3溶液中 少量Al2(SO4)3溶液滴入氨水中 C FeO与足量的盐酸 FeO与足量的稀硝酸 D 0.1 mol Cl2通入含0.2 mol FeBr2的溶液中 0.1 mol Cl2通入含0.2 mol FeCl2的溶液中
17.
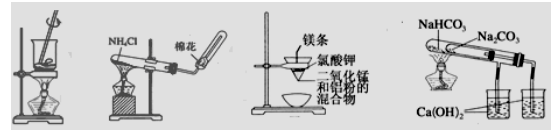 用下列装置能达到有关实验目的的是
用下列装置能达到有关实验目的的是甲 乙 丙 丁
A.用甲图装置灼烧海带成海带灰 B.用乙图装置实验室制氨气
C.用丙图装置可制得金属锰 D.用丁图装置验证NaHCO3和Na2CO3的稳定性
18. 有3份等质量的小苏打,第1份直接与盐酸恰好完全反应;第2份首先加热,使其部分分解后,再与盐酸恰好完全反应;第3份首先加热,使其完全分解后,再与盐酸恰好完全反应。假若盐酸的物质的量浓度相同,消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是
A.V1>V2>V3 B.V1>V3>V2 C.V2>V3>V1 D.V1=V2=V3
19. 某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是
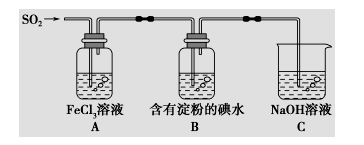
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液退色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色退去
20. FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为( )
A.1:6 B.1:7 C.2:11 D.16:25
21. (12分)减少二氧化碳的排放是一项重要课题。
(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)
在0.1 MPa时,按
①该反应的△H__________0(填“>”、“=”或“<”)。
②曲线b表示的物质为__________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是__________。
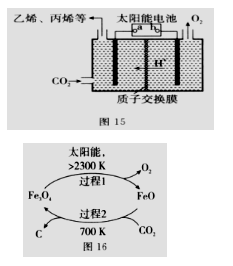 (2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图15所示。
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图15所示。①该工艺中能量转化方式主要有_________。
②b为电源的________(填“正”或“负”)极,电解时,生成乙烯的电极反应式是_________。
(3)以CO2为原料制取碳(C)的太阳能工艺如图16所示。
①过程1每反应1mol Fe3O4转移电子的物质的量为__________。
②过程2发生反应的化学方程式是__________。
22. (12分)某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
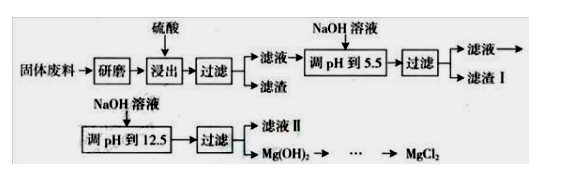
部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表,请回答下列问题:
沉淀物 Fe3+ Al3+ Mg2+ PH 3.2 5.2 12.4 (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(2)滤渣I的主要成分有 。
(3)从滤液Ⅱ中可回收利用的主要物质有 。
(4)若将MgCl2溶液加热蒸干得到的固体是____,若要得到MgCl2应采取的操作是_____。
(5)用稀硫酸酸浸时形成滤渣的离子方程式有_____________________________。
23. (10分)废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O],流程设计如下:
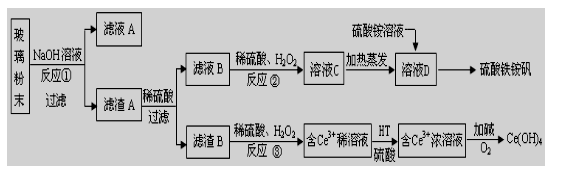
已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答以下问题:
(1)反应①的离子方程式是 。
(2)反应②中H2O2的作用是 。
(3)反应③的离子方程式是 。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+ (水层)+ 6HT(有机层) 2CeT3 (有机层)+ 6H+(水层)
从平衡角度解释:向CeT3 (有机层)加入H2SO4 获得较纯的含Ce3+的水溶液的原因是 。
(5)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是 。
24. (13分)实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ. 用pH试纸检验,漂白液pH>7,饱和
Ⅱ. 取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ. 另取10 mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ. 再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出相应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。
用图18所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。
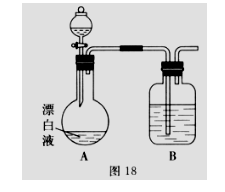
①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式__________。
③若打开分液漏斗活塞向烧瓶中加入饱和
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是__________。
25. (13分)亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验),查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+。
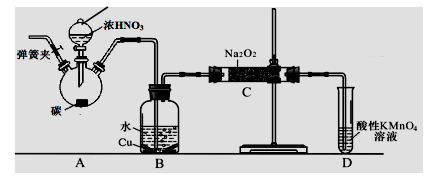 ③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸高中化学模拟题
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
(1)装置中仪器a的名称为 ;D装置的作用是 。
(2)A中反应的化学方程式是 ;
C中反应生成NaNO2的化学方程式是 。
(3)检验C中产物有亚硝酸钠的正确操作是
a.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2。
b.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2。
(4)经检验C产物中亚硝酸钠含量较少。
①.甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是__ ______(写名称)。
②.乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 。
(5)NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg。从1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再用0.00500mol/L的高锰酸钾(酸性)溶液滴定,消耗高锰酸钾溶液16.00mL,由此计算隔夜熟肉中NaNO2的含量是____________mg/kg。
中山一中2017届高三第一次统测 化学试题答案
选择题答案:1-20 DCCCB BABCB CBBAD DCDDB
21. (12分)
(1)①<(1分) ②H2O(1分) ③加压(或不断分离出水) (1分,改变投料比也应得分)
(2)①太阳能转化为电能;电能转化为化学能 (2分)
②正(1分) 2CO2+12H+ 高中化学模拟题 +12e-=C2H4+4H2O (2分)
(3)①2mol(2分) ②6FeO+CO2
22.(12分)
(1)升高温度、搅拌、多次浸取等(2分)
(2)Fe(OH)3 Al(OH)3(2分) (3)Na2SO4(1分)
(4) Mg(OH)2(1分) 在HCl的气流中将MgCl2溶液加热蒸干(2分)
(5) MgSiO3+2H+=H2SiO3+Mg2+ (2分)
CaMg(CO3)2+SO42-+4H+ = CaSO4+Mg2++2CO2↑+2H2O(2分)
23.(10分)
(1)SiO2 + 2OH- = SiO32- + H2O(2分)
(2)氧化使Fe2+转化为Fe3+ (2分)
(3)2GeO2 + 6H+ + H2O2 = 2Ge3+ + 4H2O + O2↑ (2分)
(4)混合液中加入H2SO4使c(H+)增大,平衡向形成Ge3+水溶液方向移动。(2分)
(5)Fe3+ + 3H2O Fe(OH)3(胶体) + 3H+ (2分)
24. (13分)
(1)①ClO-+H2OHClO+OH- (2分)
②ClO-+SO32-=Cl-+SO42- Ba2++SO42-=BaSO4↓ (2分,合并写出应得分)
③ClO-的氧化性随c(H+)增大而增强 (1分)
(2)①吸收Cl2 (1分) NaOH溶液 (1分)
②ClO-+Cl-+2H+=Cl2↑+H2O (2分)
③3ClO-+3Cl-+2Al3++3H2O=3Cl2↑+2Al(OH)3↓ (2分)
(3)产生白色沉淀,溶液由无色变黄绿色,最后溶液变无色 (2分)
25.(13分)(1)分液漏斗(1分); 除去未反应的NO,防止污染空气(2分)。
(2)C +4HNO3(浓)= CO2↑+ 4NO2↑+ 2H2O;(2分)
2NO+Na2O2=2NaNO2(2分)。
(3)b(1分)(4)①. 碱石灰(1分);②. 打开弹簧夹,通入N2一段时间(2分)。
(5)13.8(2分)
高中化学模拟题
推荐文章
- 甘肃兰州第一中学2016_甘肃兰州第一中学2017届高三9月月考数学理科试题及答案
- 吉林通化2015|吉林通化2017届高三上学期第一次质量检测物理试题及答案
- 黄冈市地图_黄冈市2016年高三年级9月质量检测地理试题及答案
- 通化天气|吉林通化2017届高三上学期第一次质量检测数学文科试题及答案
- [甘肃兰州第一中学2016]甘肃兰州第一中学2017届高三9月月考物理试题及答案
- 【牡丹江一中录取分数线】黑龙江牡丹江一中2017届高三9月月考政治试题及答案
- 【宜昌金东方教育集团】湖北宜昌金东方高级中学2017届高三9月月考数学文科试题答案
- 【宜昌金东方教育集团】湖北宜昌金东方高级中学2017届高三9月月考英语试题答案
- 牡丹江一中录取分数线|黑龙江牡丹江一中2017届高三9月月考英语试题及答案
- [甘肃省兰州第一中学官网]甘肃兰州第一中学2017届高三9月月考生物试题及答案